| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 肝細胞癌 | 一次治療 | 第3相 | 全生存期間 無増悪生存期間 |
国際 | あり |
試験名 :IMbrave150 trial
レジメン:アテゾリズマブ+ベバシズマブ vs ソラフェニブ
登録期間:2018年3月15日〜2019年1月30日
背景
切除不能肝細胞癌に対する一次治療として、マルチキナーゼ阻害薬であるソラフェニブ(SFB)とレンバチニブが承認されている。抗PD-L1抗体であるアテゾリズマブ(Atezo)と抗VEGF抗体であるベバシズマブ(BEV)を併用した第1b相試験において、有望な治療効果(奏効率: 36%、無増悪生存期間中央値: 7ヶ月)と忍容性が報告された。そこで今回、切除不能肝細胞癌に対する一次治療として、Atezo+BEVとSFBを比較した非盲検無作為化比較第3相試験が行われた。
シェーマ
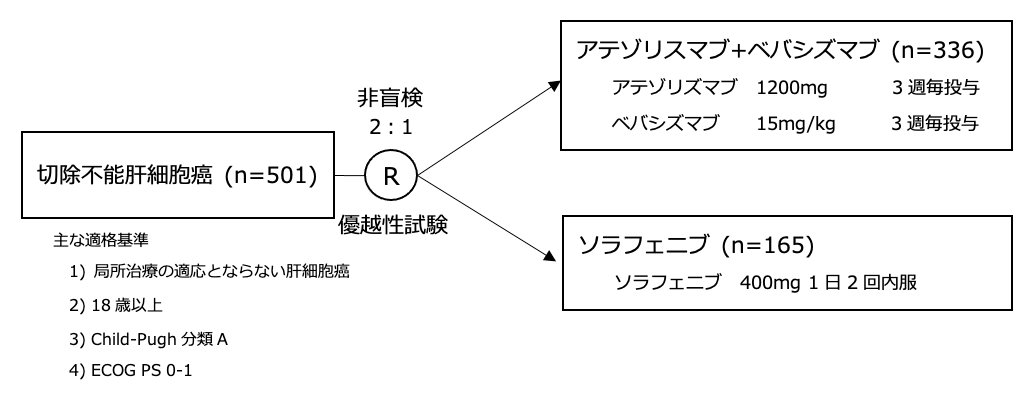
統計学的事項
主要評価項目:全生存期間、無増悪生存期間
本試験はSFB群を対照として、Atezo+BEV群の全生存期間のハザード比が0.71となることを検証する優越性試験として設計され、検出力80%、全体の両側 α=0.05とし、全生存期間は α=0.048、無増悪生存期間は α=0.002とした。480例の登録・312イベントが必要と設定された。試験結果:
- 2018年3月から2019年1月の間に、17カ国111施設から501例が登録され、336例がAtezo+BEV群に、165例がSFB群に割り付けられた。
- 患者背景に大きな隔たりは認められなかった。
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.58 (95%C.I. 0.42–0.79) p<0.001 |
|
| Atezo+BEV群 (n=336) | 未到達 | – | |
| SFB群 (n=165) | 13.2ヶ月 | 10.4–NE |
2. 生存割合
| 6ヶ月生存割合 | 95%信頼区間 | 1年生存割合 | 95%信頼区間 | |
|---|---|---|---|---|
| Atezo+BEV群 (n=336) | 84.8% | 80.9–88.7 | 67.2% | 61.3–73.1 |
| SFB群 (n=165) | 72.2% | 65.1–79.4 | 54.6% | 45.2–64.0 |
3. 無増悪生存期間(主要評価項目, RECIST1.1, 中央判定)
| 中央値 | 95%信頼区間 | HR 0.59 (95%C.I. 0.47–0.76) p<0.001 |
|
| Atezo+BEV群 (n=336) | 6.8ヶ月 | 5.7–8.3 | |
| SFB群 (n=165) | 4.3ヶ月 | 4.0–5.6 |
4. 奏効割合 (RESIST1.1, 中央判定)
| 奏効割合 (RESIST1.1) | 95%信頼区間 | P<0.001 | |
| Atezo+BEV群 (n=336) | 27.3% (CR18例、PR71例) | 22.5–32.5 | |
| SFB群 (n=165) | 11.9% (CR0例、PR19例) | 7.4–18.0 |
5. 奏効割合 (HCC-Specific mRECIST, 中央判定)
| 奏効割合 (HCC-Specific mRECIST) |
95%信頼区間 | P<0.001 | |
| Atezo+BEV群 (n=336) | 33.2% (CR33例、PR75例) | 28.1–38.6 | |
| SFB群 (n=165) | 13.3% (CR3例、PR18例) | 8.4–19.6 |
6. QOL・身体機能・役割機能低下までの期間(EORTC QLQ-C30)
| QOL | 身体機能 | 役割機能 | |
|---|---|---|---|
| 中央値(95%信頼区間) | 中央値 | 中央値 | |
| Atezo+BEV群 (n=336) | 11.2ヶ月 (6.0–NE) | 13.1ヶ月 | 9.1ヶ月 |
| SFB群 (n=165) | 3.6ヶ月 (3.0–7.0) | 4.9ヶ月 | 3.6ヶ月 |
| HR0.63 (95%C.I.0.46–0.85) |
HR 0.53 (95%C.I. 0.39–0.73) |
HR 0.62 (95%C.I. 0.46–0.84) |
7. 有害事象(NCI CTCAE ver.4.0)
| Atezo+BEV群(n=329) | SFB群(n=156) | |||
|---|---|---|---|---|
| 全Grade | Grade 3/4 | 全Grade | Grade 3/4 | |
| 高血圧 | 98 (29.8%) | 50 (15.2%) | 38 (24.4%) | 19 (12.2%) |
| 疲労 | 67 (20.4%) | 8 (2.4%) | 29 (18.6%) | 5 (3.2%) |
| 蛋白尿 | 66 (20.1%) | 10 (3.0%) | 11 (7.1%) | 1 (0.6%) |
| AST上昇 | 64 (19.5%) | 23 (7.0%) | 26 (16.7%) | 8 (5.1%) |
| 掻痒症 | 64 (19.5%) | 0 | 15 (9.6%) | 0 |
| 下痢 | 62 (18.8%) | 6 (1.8%) | 77 (49.4%) | 8 (5.1%) |
| 食欲低下 | 58 (17.6%) | 4 (1.2%) | 38 (24.4%) | 6 (3.8%) |
| 発熱 | 59 (17.9%) | 4 (1.2%) | 15 (9.6%) | 2 (1.3%) |
| ALT上昇 | 46 (14.0%) | 12 (3.6%) | 14 (9.0%) | 2 (1.3%) |
| 便秘 | 44 (13.4%) | 0 | 22 (14.1%) | 0 |
| ビリルビン上昇 | 43 (13.1%) | 8 (2.4%) | 22 (14.1%) | 10 (6.4%) |
| 皮疹 | 41 (12.5%) | 0 | 27 (17.3%) | 4 (2.6%) |
| 腹痛 | 40 (12.2%) | 4 (1.2%) | 27 (17.3%) | 4 (2.6%) |
| 嘔気 | 40 (12.2%) | 1 (0.3%) | 25 (16.0%) | 1 (0.6%) |
| 咳嗽 | 39 (11.9%) | 0 | 15 (9.6%) | 1 (0.6%) |
| インフュージョンリアクション | 37 (11.2%) | 8 (2.4%) | 0 | 0 |
| 体重減少 | 37 (11.2%) | 0 | 15 (9.6%) | 1 (0.6%) |
| 血小板減少 | 35 (10.6%) | 11 (3.3%) | 18 (11.5%) | 2 (1.3%) |
| 鼻出血 | 34 (10.3%) | 0 | 7 (4.5%) | 1 (0.6%) |
| 無力 | 22 (6.7%) | 1 (0.3%) | 21 (13.5%) | 4 (2.6%) |
| 脱毛 | 4 (1.2%) | 0 | 22 (14.1%) | 0 |
| 手掌・足底発赤知覚不全症候群 | 3 (0.9%) | 0 | 75 (48.1%) | 13 (8.3%) |
結語
切除不能肝細胞癌に対する一次治療として、Atezo+BEV群はSFB群に比較して、全生存期間と無増悪生存期間を有意に延長した。
執筆:神奈川県立がんセンター 消化器内科・肝胆膵 佐野 裕亮 先生
監修:国立がん研究センター東病院 肝胆膵内科 科長 池田 公史 先生
監修:国立がん研究センター東病院 肝胆膵内科 科長 池田 公史 先生